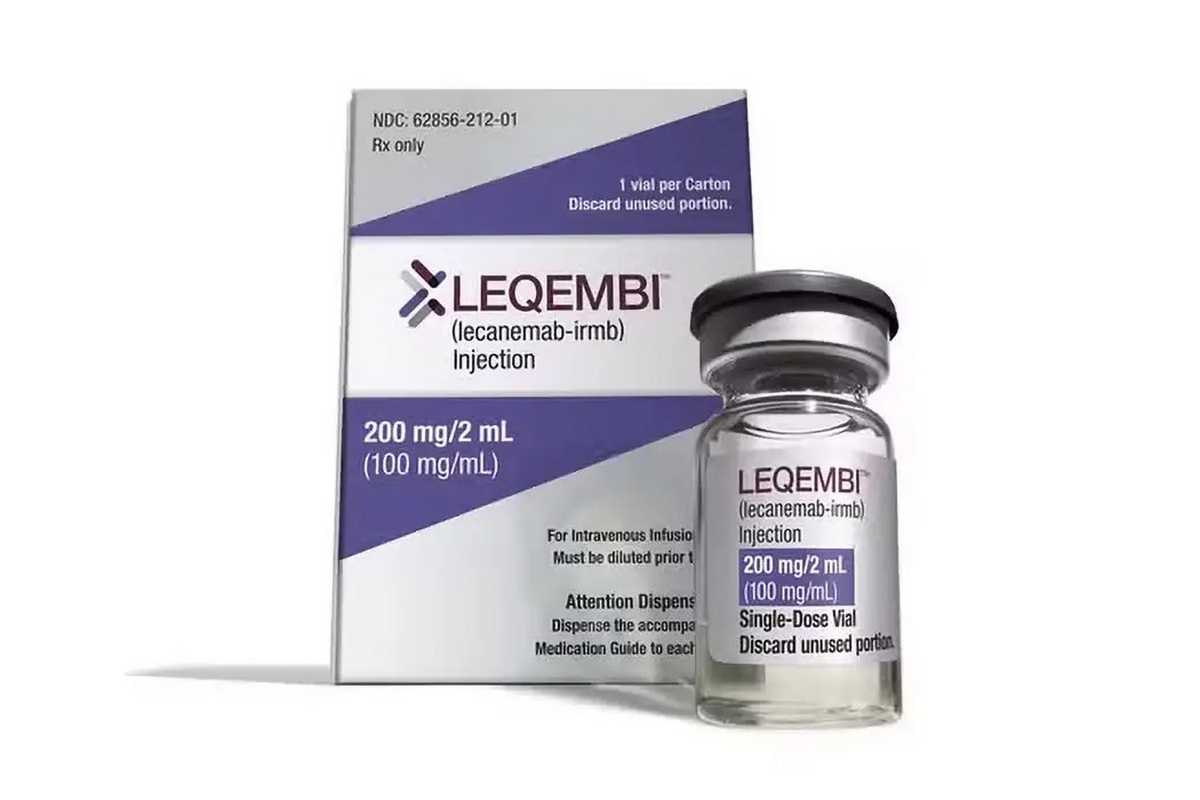
Medicamento inédito para tratamento de Alzheimer no Brasil é aprovado pela Anvisa
A Agência Nacional de Vigilância Sanitária (Anvisa) autorizou o uso do lecanemabe, um anticorpo monoclonal biológico indicado para pacientes em estágio inicial de Alzheimer, que é uma doença neurodegenerativa crônica e a forma mais comum de demência.
A decisão foi publicada nesta quinta-feira, 8 de janeiro de 2026.
O prazo para chegada ao mercado brasileiro dependerá do laboratório responsável pelo registro e da definição de estratégias de comercialização.
O que é o lecanemabe e por que a aprovação é histórica
O lecanemabe é um medicamento biológico inovador desenvolvido especificamente para atuar na fisiopatologia da doença de Alzheimer.
Ele pertence à classe dos anticorpos monoclonais, projetados para se ligar seletivamente às placas de beta-amiloide no cérebro — uma das principais características associadas à progressão da doença.
Diferentemente dos tratamentos atualmente disponíveis no Brasil, que atuam apenas no alívio dos sintomas, o lecanemabe tem como proposta interferir no curso da doença, retardando a progressão do comprometimento cognitivo em pacientes selecionados.
De acordo com o registro concedido pela Anvisa, o uso do lecanemabe é indicado exclusivamente para pacientes adultos em fase inicial da doença de Alzheimer, respeitando critérios clínicos rigorosos.
Indicação aprovada inclui pacientes com:
-
Diagnóstico clínico de comprometimento cognitivo leve ou demência leve decorrentes da doença de Alzheimer
-
Doença em fase inicial, com sintomas ainda leves
-
Patologia amiloide confirmada, por exames específicos
-
Pacientes que não sejam portadores ou que sejam heterozigotos do alelo ε4 da apolipoproteína E (ApoE ε4)
A restrição genética é relevante, pois o alelo ApoE ε4 está associado a maior risco de efeitos adversos em terapias antiamiloides, o que exige avaliação médica criteriosa antes da prescrição.
Como deverá funcionar a administração do lecanemabe
O medicamento deve ser administrado exclusivamente em ambiente de saúde, seguindo protocolo específico:
-
Via de administração: infusão intravenosa
-
Duração da infusão: aproximadamente uma hora
-
Frequência: uma vez a cada duas semanas
Acompanhamento médico
A aprovação do lecanemabe pela Anvisa foi baseada na análise de dados clínicos que demonstraram redução da progressão do declínio cognitivo em pacientes selecionados, quando comparados ao placebo.
O uso requer avaliação individualizada, considerando riscos, benefícios e perfil genético do paciente.
A Anvisa esclarece que o prazo para início da comercialização dependerá do laboratório detentor do registro, que ainda precisará definir logística e estratégias de acesso ao tratamento.